Szczep Bacillus subtilis PXN®21™ w zapobieganiu kumulacji alfa-synukleiny u nicieni (C. elegans)
Artykuł opublikowany w Cell Reports w styczniu 2020 r., opisuje badanie, które pokazuje, w jaki sposób szczep Bacillus subtilis PXN®21™ może spowolnić, a nawet cofnąć gromadzenie się jednego z głównych białek związanych z chorobą Parkinsona, przy użyciu dobrze przebadanego modelu nicieni.1
Tło:
Choroba Parkinsona (ang. Parkinson’s Disease – PD) jest drugim najczęstszym zaburzeniem neurodegeneracyjnym, zaraz po chorobie Alzheimera. Cierpi na nią około 10 milionów ludzi na całym świecie. Jej głównymi objawami są drżenie, sztywność i spowolnienie ruchowe, a wielu chorych doświadcza również upośledzenia funkcji poznawczych.
Wstęp:
Alfa-synukleina to białko występujące w dużych ilościach w ludzkim mózgu. W chorobie Parkinsona alfa-synukleina ulega nieprawidłowemu składaniu i kumulacji, tworząc toksyczne grudki lub złogi w strukturach nerwowych. Nie jest dokładnie wiadomym, co powoduje tę nieprawidłowość i zlepianie się białek, ale proces ten istotnie wpływa na rozwój choroby Parkinsona.
Choroba Parkinsona jest obecnie nieuleczalna, ale istnieją leki mogące złagodzić jej objawy. Wpływ na alfa-synukleinę stał się głównym celem potencjalnej terapii tego schorzenia. Ostatnie badania koncentrują się na zmniejszeniu ekspresji genu alfa-synukleiny lub sposobach jego usunięcia w nadziei, że pomoże to zahamować – i potencjalnie odwrócić – uszkodzenia, jakie te złogi białka spowodowały w ludzkim mózgu.
Ostatnie doniesienia naukowe:
W ostatnim czasie to mikrobiom jelitowy człowieka okazał się potencjalnie ważnym czynnikiem mogącym wpłynąć na rozwój choroby Parkinsona.2 Zauważono, że mikrobiota przewodu pokarmowego osób chorych znacząco różni się od tej, jaką posiadają osoby zdrowe, które wzięły udział w ramieniu kontrolnym. Szczególne różnice zaobserwowano w zwiększonej ilości bakterii z rodzaju Akkermansia i zmniejszonej ilości bakterii z rodzaju Prevotellaceae.3
Co ciekawe, różnice w analizie składu mikrobiomu przewodu pokarmowego korelowały z objawami klinicznymi choroby Parkinsona.
Istnieje coraz więcej dowodów na to, że bakterie jelitowe mogą wpływać na dolegliwości pochodzące z odległych od przewodu pokarmowego miejsc, mając potencjalne zastosowanie w przypadku zaburzeń neuropsychiatrycznych, takich jak lęk, depresja, choroba afektywna dwubiegunową czy migrena.4
Wykazano, że przeszczep kału od pacjentów z chorobą Parkinsona nasilają objawy tej choroby u myszy, co pokazuje, że różnice w składzie mikrobioty są nie tylko wynikiem choroby, ale wpływają również na jej progresję.5
Badanie:
Uczestnicy:
Ludzki mikrobiom składa się z miliardów bakterii, co stanowi wyzwanie w kontekście zrozumienia wpływu poszczególnych szczepów na ludzki organizm. Pomocne w tym przypadku mogą okazać się nicienie, szczególnie Caenorhabditis elegans, które żywią się bakteriami. Oferują one możliwość odtworzenia wielu warunków ludzkiej fizjologii, pomagając uzyskać kluczowe informacje na temat procesów chorobowych człowieka.
Aby ocenić wpływ bakterii jelitowych na agregację alfa-synukleiny, zespół badawczy z uniwersytetów w Edynburgu i Dundee wykorzystał model C. elegans (szczep NL5901) w celu odzwierciedlenia procesów związanych z ludzką alfa-synukleiną.
Nicienie karmiono różnymi bakteriami: E. coli (zwyczajowa dieta laboratoryjna dla C. elegans), Bacillus subtilis PXN®21™ (szczep ADM Protexin) lub ich kombinację. Następnie oceniano ich wpływ pod kątem kumulacji alfa-synukleiny na różnych etapach.
Wyniki:
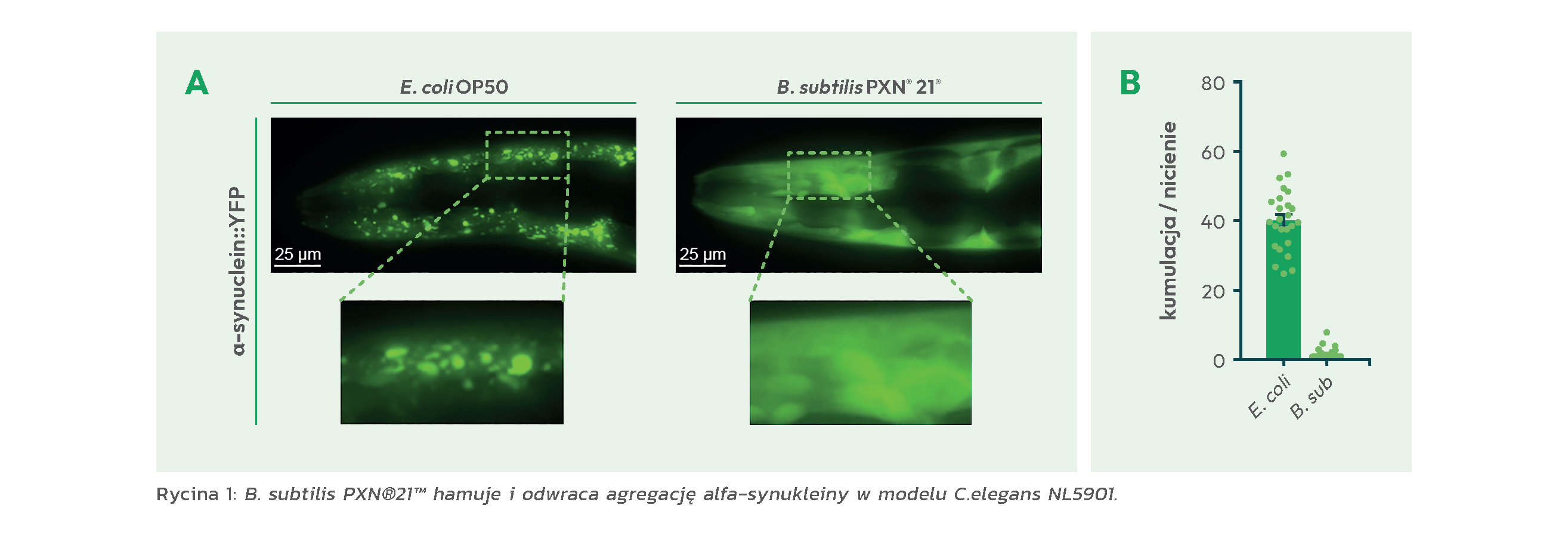
C. elegans karmione bakterią E. coli gromadziły alfa-synukleinę ju ż na bardzo wczesnym etapie rozwoju. Natomiast C. elegans karmione bakteriami B. subtilis praktycznie nie wykazywały kumulacji alfa-synukleiny od stadium larwalnego do wczesnej dorosłości (Ryc. 1).
Nicienie karmione bakterią E. coli w stadium larwalnym wykazały znaczne zmniejszenie złogów alfa-synukleiny po przejściu na dietę B. subtilis.
B. subtilis wpłynął również na poprawę komunikacji, utraconej w związku z tworzeniem się złogów białka.
Mechanizm działania Bacillus subtilis
Bacillus subtilis zwiększa żywotność i odporność na stres u C. elegans. Jednym z mechanizmów wykorzystywanych przez B. subtilis do wywoływania tych efektów jest wpływ na zwiększenie tworzenia się biofilmu – śluzowej błony biologicznej, którą bakterie wytwarzają, i w której żyją jako społeczność, co umożliwia im lepszą komunikację i dzielenie się składnikami odżywczymi. Tworzenie biofilmu wiąże się ze wzrostem wydzielania tlenku azotu (NO) i czynnika stymulującego tworzenie kolonii (CSD), dwóch produktów bakteryjnych niezbędnych do przedłużenia żywotności C. elegans. Tlenek azotu jest również ważny w utrzymywaniu niskiego poziomu kumulacji alfa-synukleiny u nicieni karmionych B. subtilis.
Badania wykazały, że zaburzenia metabolizmu niektórych tłuszczów (sfingolipidów) są powiązane z gromadzeniem się alfa-synukleiny w chorobie Parkinsona. Powyższe badanie pokazuje, że szczep Bacillus subtilis reguluje w górę szlaki metabolizmu lipidów, co wpływa na zmniejszenie kumulacji alfa-synukleiny.
Wnioski:
Bacillus subtilis PXN®21®, szczep probiotyczny dostępny w preparatach dla ludzi, hamuje kumulowanie się i skutecznie zmniejsza wstępnie utworzone złogi alfa-synukleiny w modelu C. elegans, mającym odzwierciedlić ten proces u ludzi.
Szczep ten wykazuje działanie ochronne na alfa-synukleinę poprzez modyfikację szlaków immunologicznych u gospodarza, wspomagając tworzenie biofilmu i metabolizm sfingolipidów.
Odkrycia te stanowią silną podstawę do podjęcia badania potencjału Bacillus subtilis PXN®21® w warunkach klinicznych na ludziach.
B. subtilis hamuje i odwraca agregację alfa-synukleiny w synukleinopatii / chorobie Parkinsona na przykładzie modelu C.elegans. Potencał ochronny B. subtilis skutecznie przeciwdziała procesom starzenia się C. elegans.
Bacillus subtlis PXN® 21® jest komercyjnym szczepem bakterii i jest zawarty w formułach Bio-Kult. Można go znaleźć w Bio-Kult Everyday, Bio-Kult Migréa i Bio-Kult Mind.
Bibliografia:
1. Goya ME, Xue F, Sampedro-Torres-Quevedo C, Arnaouteli S, Riquelme-Dominguez L, Romanowski A, et al. Probiotic Bacillus subtilis Protects against alfa-Synuclein Aggregation in C. elegans. Cell Rep. 2020 Jan 14;30(2):367-380.e7.
2. Scheperjans F. Gut microbiota, 1013 new pieces in the Parkinson’s disease puzzle. Vol. 29, Current Opinion in Neurology. Lippincott Williams and Wilkins; 2016. p. 773–80.
3. Boertien JM, Pereira PAB, Aho VTE, Scheperjans F. Increasing Comparability and Utility of Gut Microbiome Studies in Parkinson’s Disease: A Systematic Review. J Parkinsons Dis. 2019;9(s2):S297–312.
4. Clapp M, Aurora N, Herrera L, Bhatia M, Wilen E, Wakefield S. Gut microbiota’s effect on mental health: the gut-brain axis. Clin Pract. 2017 Sep 15;7(4).
5. Sampson TR, Debelius JW, Thron T, Janssen S, Shastri GG, Ilhan ZE, et al. Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson’s Disease. Cell. 2016 Dec 1;167(6):1469-1480.e12.
6. Lloyd-Price J, Abu-Ali G, Huttenhower C. The healthy human microbiome. Vol. 8, Genome Medicine. BioMed Central Ltd.; 2016.
7. Branda SS, Vik Å, Friedman L, Kolter R. Biofilms: The matrix revisited. Vol. 13, Trends in Microbiology. 2005. p. 20–6.
8. Smolentseva O, Gusarov I, Gautier L, Shamovsky I, Defrancesco AS, Losick R, et al. Mechanism of biofilm-mediated stress resistance and lifespan extension in C. Elegans. Sci Rep. 2017 Dec 1;7(1).
9. Donato V, Ayala FR, Cogliati S, Bauman C, Costa JG, Leñini C, et al. Bacillus subtilis biofilm extends Caenorhabditis elegans longevity through downregulation of the insulin-like signalling pathway. Nat Commun. 2017 Jan 30;8.
